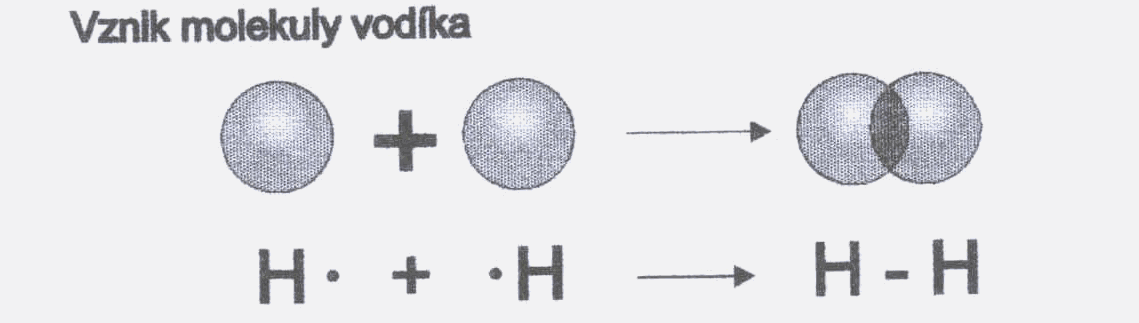|
|
 |
|
Názov školy:
PRÍPRAVA NA VYUČOVACIU HODINU CHÉMIE
1. hodina
Meno vyučujúceho:
Dátum: .................................................................................................................................................
Ročník a trieda: ...................................................................................................................................
Téma vyučovacej hodiny: CHEMICKÁ
väzba – definícia, história
Výchovno-vzdelávací
cieľ: vytvoriť si
predstavu o chemickej väzbe, ovládať definíciu a poznať
historický vývoj predstáv o chemickej väzbe
Typ vyučovacej hodiny: vyučovacia hodina
prvotného osvojovania poznatkov
Použité vyučovacie metódy:
- Metódy motivačné: motivačné roz
právanie
Metódy priameho prenosu poznatkov: výklad, vysvetľovanie
Metódy sprostredkovaného prenosu poznatkov: demonštrácia
pomocou CD nosiča
Fixačné metódy: metóda otázok a odpovedí
Použité vyučovacie pomôcky: farebné kriedy, učebné
texty, CD nosiče: „Animovaná chémia“,„Chemie
II“
Použitá didaktická technika :
počítač
Štruktúra vyučovacej hodiny:
1. Organizačná časť:
- zápis do triednej knihy, prezencia
2. Motivačná časť:
motivačným rozprávaním o dôležitosti existencie
chemickej väzby vzbudiť u žiakov záujem
o novú problematiku (ukážka z programu „Chemie II“)
3. Expozičná časť:
Výklad: 1. DEFINÍCIA A VYTVORENIE PREDSTAVY
O CHEMICKEJ VäZBE
Chemické väzby
sú súdržné sily pútajúce navzájom zlúčené atómy v molekulách
a kryštáloch. (ukážka z programu
„Animovaná chémia“)
Podmienkou pre vznik molekúl z atómov je
vznik chemickej väzby, opačný proces je príčinou zániku väzieb.
Ku vzniku a štiepeniu chemických väzieb
dochádza pri chemických reakciách.
Zopakujme si !!! - Chemická reakcia je
dej, pri ktorom zanikajú východiskové látky (rušia sa chemické
väzby v ich molekulách) a vznikajú nové látky –
produkty reakcie (utvárajú sa nové chemické väzby).
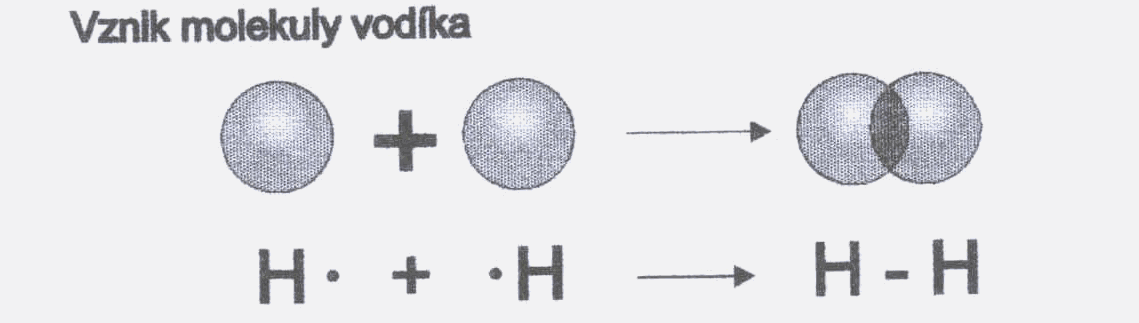
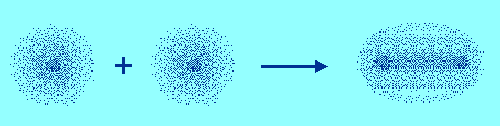
Obr. č. 1: Ukážka vzniku chemickej väzby v molekule
vodíka
2.
Historický pohľad na vývoj predstáv o chemickej väzbe
Najväčšiu zásluhu na vysvetlení
podstaty chemickej väzby v minulosti majú:
J. J. BERZELIUS
E. FRANKLAND
W. KOSSEL, G. N. LEWIS
Jons Jacob BERZELIUS
(1779 – 1848)


Obr. č.
2: Jons Jacob Berzelius
- švédsky chemik, mineralóg a lekár
-
predpokladal, že chemické
zlučovanie spôsobujú elektrické sily
Podľa Berzelia prevláda pri niektorých
atómoch kladný náboj, pri iných záporný náboj. Tvorba
zlúčeniny je zapríčinená spojením atómov alebo
atómových skupín, na ktorých prevládajú opačné náboje.
Prax vyvrátila túto tzv. dualistickú
teóriu ,
ktorá rozdeľovala prvky na dve skupiny, a to na také, ktoré
sú nositeľmi kladného elektrického náboja a na také,
ktoré sú nositeľmi záporného elektrického náboja.
E. FRANKLAND

Obr. č. 3: E. Fr ankland
- V r. 1852 Angličan E. FRANKLAND
prišiel
k záveru, že atóm
prvku sa môže zlučovať len s určitým počtom atómov
iných prvkov.
Túto vlastnosť prvkov pomenovali mocenstvom
alebo valenciou.
- Takto definované mocenstvo zohralo v rozvoji klasickej
chémie v
eľmi
významnú úlohu, napr. pri objavovaní periodického zákona
alebo pri formulácii teórie chemickej štruktúry látok.
W. KOSSEL, Gilbert Edward LEWIS


Obr. č. 4: W. Kossel a Gilbert Edward Lewis
- Na základe znalostí o elektrónovej štruktúre atómov
vypracovali v roku 1915 nemecký fyzik W. KOSSEL a
v roku 1916 americký fyzik G. N. LEWIS prvé teórie
chemickej väzby. Kossel vypracoval teóriu
iónovej väzby, Lewis je autorom teórie kovalentnej
väzby.
3. Fixačná časť:
- metódou otázok a odpovedí zh
rnúť
učivo:
- Uveďte charakteristiku chemických väzieb.
- Definujte pojem chemická reakcia.
3. Vysvetlite podstatu a neopodstatnenosť
dualistickej teórie. Kto bol jej autorom?
4. Doplňte: Kossel je autorom teórie
................... väzby, Lewis je autorom
teórie .................... väzby.
4. Záver:
- nabudúce pokračujeme energetickými zmenami pri vzniku
chemickej väzby, rozdelením chemických väzieb
a kovalentnou väzbou

| |